本文是一篇康复医学论文,笔者认为H2S 通过硫巯基化 MDM2 促进 P53 的泛素化降解,从而改善了 BLM 诱导的肺纤维化。在后续的实验中,我们将通过突变 MDM2蛋白上的潜在硫巯基化位点观察 MDM2 硫巯基化以及 P53 泛素化降解水平是否下降来进一步明确 H2S 是否通过硫巯基化 MDM2 发挥作用。
1、前言
肺纤维化是在肺部疾病中常见的一种典型的病理特征[1]。特发性肺纤维化(IPF)是其中最为常见的。其同时也是致死率最高的间质性肺疾病,其确诊以后患者的中位生存率仅为 2 至 5 年。目前对于肺纤维化的发病机制还没有足够的了解,因此除了肺部移植以外对于这种疾病并没有有效的治疗措施[2]。目前认为 IPF 发病机制主要是肺泡上皮细胞(AEC)损伤和成纤维细胞活化。
细胞衰老是一个极其复杂的病理生理过程,即细胞从正常生长状态变为不可逆的生长停滞状态的过程。越来越多的证据表明细胞衰老与机体功能老化以及老化引起的疾病包括肺纤维化有关联。细胞衰老主要受 P53 / P21 和 P16 /PRb 通路调节,P53 / P21 和 P16 / PRb 通路可协调或独立调节细胞衰老过程。然而我们对于细胞衰老的机制还不够了解。II 型肺上皮细胞可以自我更新还可以分化为 I 型肺泡上皮细胞。因此,ATII 细胞被认为是肺泡祖细胞[3,4]。II型肺上皮细胞的衰老也是肺纤维化包括 IPF 的重要发病机制[5,6,7,8]。对于 II 型肺泡上皮细胞衰老的深入了解有助于我们理解肺纤维化的病理机制并且提出相对应的有效治疗措施。
硫化氢(H2S)被认为是继一氧化氮和一氧化碳之后气体传输家族的第三成员,它在包括炎症[9],代谢紊乱[10]和血压调节[11]等许多生理和病理生理过程中都起着极其重要的作用。在哺乳动物组织中,内源性 H2S 主要来自于半胱氨酸β-合酶(CBS)和半胱氨酸-y-裂解酶(CSE)[12]。最近有实验检测到了 CBS和 CSE 在肺组织中的表达[13]。有许多实验证明内源性的 H2S 在肾纤维化和肺纤维化中都是重要的保护因子。之前的实验表明当给小鼠注射外源性 H2S 供体NaHS 时,肺纤维化会得到一定的缓解[14]。尽管如此,H2S 在这一过程中发挥保护作用的确切机制仍不清楚。
....................
2、材料与方法
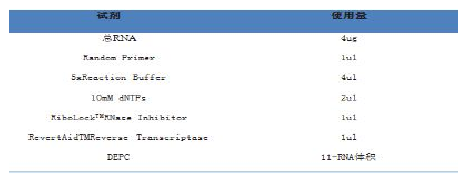
2.1 主要设备与试剂

..................
2.2 实验动物
2.2.1 实验分组
(1)八周龄雄性 ICR 小鼠 28 只,随机分为 4 组:对照组(Control),博来霉素组(BLM),硫化氢组(H2S),博来霉素+硫化氢组(BLM+H2S),每组7 只。
(2)八周龄雄性 C57 小鼠,八周龄 CBS+/-小鼠,每组 7 只。
2.2.2 运动方案及药物用量
博来霉素用量:博来霉素粉末用 PBS 成浓度为 2.4mg/ml 的液体,小鼠称重后按 3mg/kg 标准进行气管内滴注。
H2S 常用量:28uM/kg。
..........................
3主要实验技术.......................... 17
3.1提取蛋白.......................... 17
3.2蛋白质印记分析............................ 18
3.2实时荧光定量 PCR(Real-time PCR)..........................18
4统计学分析..............................22
5研究结果......................22
6.分析与讨论
特发性肺纤维化是一种致命疾病,造成肺泡结构的破坏,导致进行性功能丧失。纤维化涉及成纤维细胞过度增殖和细胞外基质的积累。 在肺中,最常见的纤维化类型是特发性肺纤维化(IPF),IPF 是一种死亡率高,治疗选择有限的疾病。一直以来,肺纤维化被认为是慢性炎症驱动的疾病,因为在患有肺纤维化的受试者和实验动物模型中均发现多种促炎细胞因子和趋化因子表达升高[17]。 但是,使用抗炎药治疗 IPF 的 PANTHER 试验未能改善患者生理参数,反而导致治疗组死亡率和住院率增加[18]。众所周知,IPF 会影响肺泡 II 型上皮细胞(ATII),即肺泡肺泡单位的干细胞。 II 型肺泡(ATII)细胞可以自我更新并分化为 I 型肺泡上皮细胞,因此被认为是肺泡祖细胞[19]。但是,ATII 细胞促成 IPF 发病机理的机制仍然未知(May the mechanical force be with ATII )。
早在 60 年前,Hayflick 和 Moorehead 就观察到了细胞的衰老,他们发现培养中的原代人类肺细胞进行了有限的分化后便不再继续分化,由此进入了衰老状态[20]。细胞衰老是一种永久抑制细胞生长的状态,与衰老和衰老相关疾病有关。有实验结果表明,细胞衰老与包括哮喘,慢性阻塞性肺疾病和肺纤维化在内的多种肺部疾病有密切关系。如有研究发现哮喘会导致人上皮细胞中的P21/P16 表达浓度升高[21],小鼠 COPD 模型显示,暴露在香烟中会激活 p21-PARP-1 途径,导致 DNA 损伤并加剧细胞衰老[22],将培养的人肺上皮细胞暴露于香烟烟雾中可诱导 p21 上调并导致衰老[23],在 IPF 患者中,肺泡和支气管上皮细胞均表达衰老标记物 p21 和 p53[24]。我们之前的实验结果也表明,在博来霉素(BLM)诱导的肺纤维化中,肺损伤的程度会随着时间的推移而逐渐增加,同时细胞衰老标记物 P53 和 P21 的蛋白表达也呈时间依赖性的增高。离体实验也表明,经过 BLM 干预后,大鼠肺泡上皮细胞形态学发生了改变,较对照组的细胞增大且更加扁平,且对β-半乳糖酶染色更加敏感。我们对小鼠进行了为期 14 天的 BLM 器官滴注后对其肺组织进行荧光染色,通过上皮标记物 SPC 和 P53/P21 的共染,我们发现经过 BLM 滴注的小鼠肺组织中 P53和 P21 的表达明显升高。这表明,BLM 诱导肺纤维化的机制可能与 ATII 的细胞衰老密切相关。
...............................
7 结论
在正常生理条件下,p53 维持在非常低的细胞水平。然而,响应于外源和内源性应激,p53 会被迅速稳定和激活。在从应激中恢复期间维持低 p53 水平或 p53 失活主要归因于 E3 泛素连接酶 MDM2 的功能。MDM2 通过至少 3种机制控制细胞 p53 的水平和活性:(a)p53 反式激活能力的直接结合和阻断; (b)单泛素化导致 p53 从细胞核中输出; (c)多泛素化,导致 p53 的蛋白酶体降解[47,48]。实际上,MDM2 本身就是 p53 的直接转录靶标,因此形成了自动调节反馈环,因此 p53 和 MDM2 紧密调节彼此的细胞水平和活性[49.50]。将 L2 细胞分成 BLM 单独干预和 BLM+H2S 共同干预两组,通过免疫共沉淀实验发现经过 H2S 干预后可以有效泛素化降解 L2 细胞中的 P53。有研究证明,在肝细胞癌(HCC)中,当对 HCC 细胞的增殖和转移有明显抑制作用的 miR-145 模拟物能够在很大程度上抑制 MDM2 的表达,并随后上调p53/p21 的表达[51]。MDM2 是一种 E3 泛素连接酶,可调节 p53 的泛素化,导致其被蛋白酶体降解[52,53,54]。此外也有多项实验结果证明 MDM2-P53 通路参与了多种病理生理情况的调控,并成为治愈疾病的潜在靶点[55.56.57]。为了进一步验证 MDM2 和 P53 的相互作用在硫化氢改善博来霉素诱导的肺纤维化中发生的作用,我们运用免疫共沉淀方法检测了 BLM 单独干预和 BLM+H2S 共同干预两种条件下 L2 细胞中 MDM2 和 P53 相互作用程度的情况。经试验证明,经过硫化氢干预后,L2 细胞中 MDM2 和 P53 的相互作用相较于单纯使用 BLM干预的 L2 细胞有所加强。以上实验结果说明 H2S 的作用可以加强 MDM2 和P53 之间的相互作用进而促进 P53 的泛素化降解。
参考文献(略)


